Funktionsprinzip der Protonen-Austausch-Membran-Elektrolyse

Schema und Prozessschritte bei der Polymer-Elektrolyt-Membran-Elektrolyse
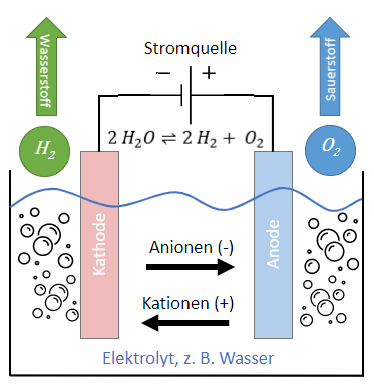
Die Protonen-Austausch-Membran-Elektrolyse, auch Proton-Exchange-Membrane-Elektrolyse (PEM-EL) nutzt zur Trennung der Produktgase und Protonenleitung ein festes Kunststoffelektrolyt als Membran und zeichnet sich durch eine dynamische Betriebsweise aus. Diese eignet sich ideal zum Ausgleich der schwankenden Erzeugungsleistung von erneuerbaren Energien wie Photovoltaik und Windenergie. Die Abbildung zeigt den schematischen Aufbau und die Prozessschritte bei der PEM-EL:
- Auf der Anodenseite des Elektrolyseurs wird Wasser (H2O) zugeführt.
- Zersetzung des H2O durch katalytische Edelmetall-Elektrode. Sauerstoff(O2) wird durch Anodenreaktion (oxygen evolution reaction, OER) erzeugt und durch die Gas-Diffusions-Schicht (gas diffusion layer, GDL) freigesetzt.
- Wasserstoff-Kation (H+) aus OER wandert über die Membran in die Kathodenhalbzelle.
- Wasserstoff wird durch Kathodenreaktion (hydrogen evolution reaction, HER) an der Kathode aus H+ erzeugt und über GDL freigesetzt.